Publiziert am:
24. Juni 2024
Basis UDI-DI und deren Vergabe
Die Basis-UDI-DI ist wichtiger Schlüssel in der Produkt-Dokumentation (z. B. Zertifikate, technische Dokumentation, Vigilanz Meldungen und PSUR, SS(C)P, etc.) und dient auch als Zugangsschlüssel zu den produktbezogenen Informationen in der europäischen Datenbank für Medizinprodukte (EUDAMED). Die Basis-UDI-DI stellt dabei eine sinnvolle Möglichkeit dar, mehrere vergleichbare Varianten eines Medizinprodukts zu gruppieren.
Wesentliche Anforderungen für die Festlegung der Basis-UDI-DI sind in MDCG 2018-1 (aktuell Rev. 4) angeführt. Es werden nur Forderungen der 2017/745 (MDR) adressiert, das Dokument wird aber auch für die Verordnung (EU) 2017/746 herangezogen. Diese Anforderungen müssen berücksichtigt werden.
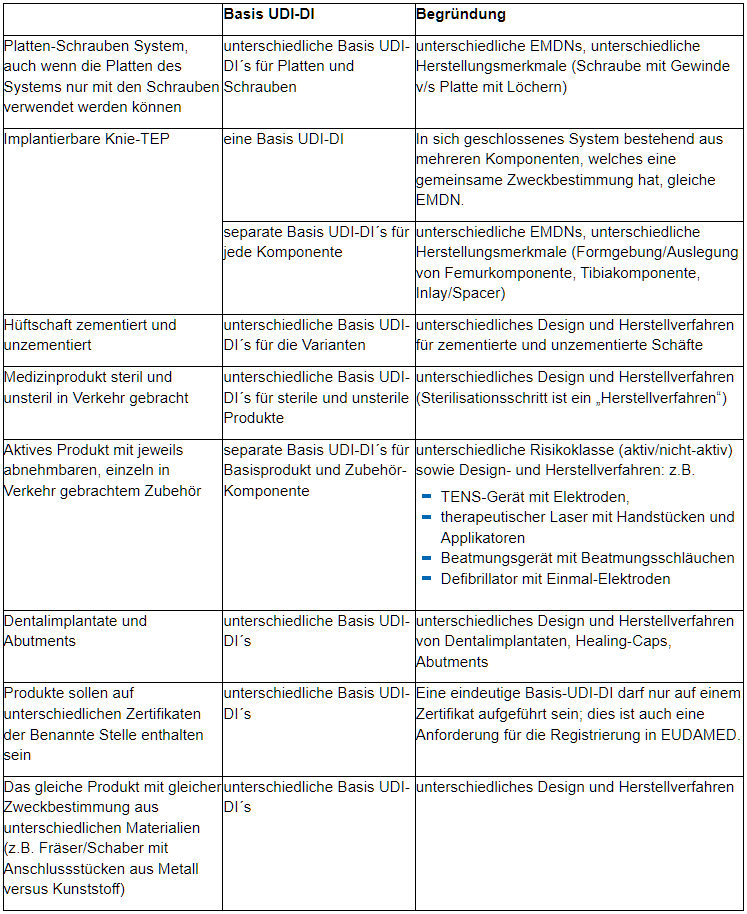
Insbesondere bei der gemeinsamen Gruppierung von Produkten sind wesentliche Aspekte zu berücksichtigen. Die folgenden Datenelemente müssen für alle gemeinsam gruppierten Produkte gleich sein.
Anforderungen für das Zusammenfassen unter derselben Basis-UDI-DI:
- Selber Hersteller (Name, Adresse, SRN)
- Selbe Risikoklasse (MDR: insbesondere hinsichtlich Implantierbarkeit, aktives Medizinprodukt, besondere Bestandteile wie Arzneimittelkomponente, Materialien tierischen Ursprungs oder stoffliche Komponenten sowie Messfunktion oder ob es sich um ein wiederverwendbares chirurgisches Element handelt; IVDR: gemäß Anhang VIII)
- Selber Medical Device Nomenclature Code (EMDN Code) – zumindest bis zur vierten Stelle
- Selbe Zweckbestimmung
- Angeführt auf demselben Produktzertifikat, PSUR, SSCP (MP) bzw. SSP (IVD)
- Gegebenenfalls gleiche (eine) Technische Dokumentation
- Gegebenenfalls s gleiche wesentliche Auslegungs- und Herstellungsmerkmale
Für IVD wird eine Basis-UDI-DI insbesondere für Sprach- und Vertriebsvarianten (z.B. Tests zur Eigenanwendung in verschiedenen Ländern für diverse Distributoren mit länderspezifischer Kennzeichnung) sowie Packungsvarianten des gleichen Produkts (z.B. 96-Well bzw. 128-Well Platten, Mehrfachabpackungen) vergeben.
Insbesondere hinsichtlich derselben wesentlichen Auslegungs- und Herstellungsmerkmale möchten wir für Medizinprodukte auf einige Aspekte hinweisen, welche zu unterschiedlichen Basis-UDI-DI führen: