Publiziert am:
09. Juli 2024
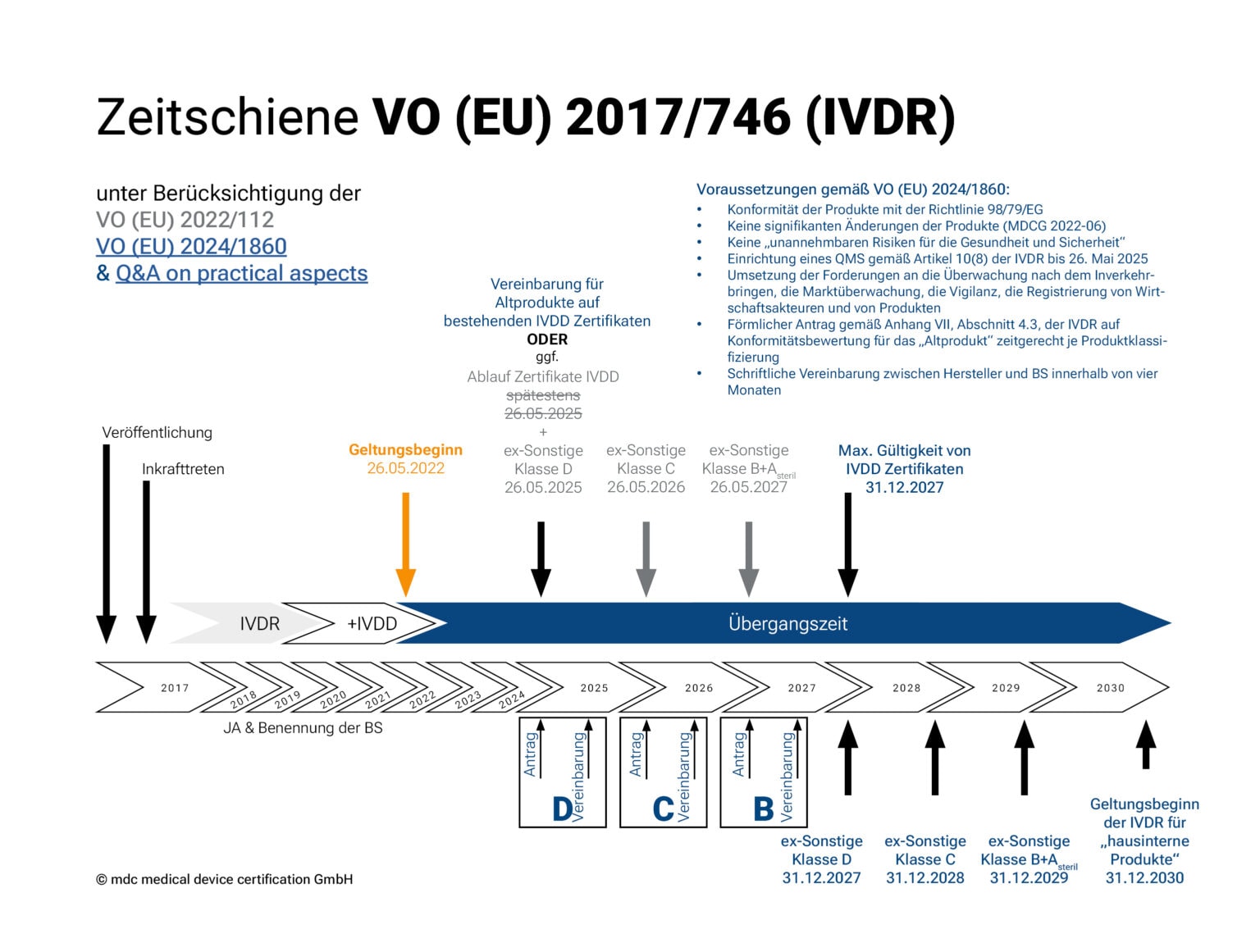
Verlängerung der Übergangszeit der IVDR gemäß Verordnung (EU) 2024/1860
Die von der EU-Kommission veröffentlichte Anpassung der Übergangsfristen der IVDR in Form der Verordnung (EU) 2024/1860 ist zum 9. Juli 2024 in Kraft getreten und soll den Herstellern und den Benannten Stellen mehr Zeit zur Umsetzung der Vorgaben der IVDR gewähren. Die verlängerten Übergangsfristen gelten ausschließlich für Bestandsprodukte („legacy devices“) mit bestehender Konformitätsbescheinigung bzw. -erklärung und sind erneut nach der Risikoklasse des Bestandprodukts gestaffelt:
• Risikoklasse D und Produkte, die ein gültiges Zertifikat nach Richtlinie 98/79/EG besitzen: bis 31. Dezember 2027
• Risikoklasse C: bis 31. Dezember 2028
• Risikoklasse B und sterile Produkte der Risikoklasse A: bis 31. Dezember 2029
Die Verlängerung ist dabei an folgende Bedingungen geknüpft:
1. Diese Produkte entsprechen weiterhin der Richtlinie 98/79/EG;
2. Keine signifikanten Änderungen der Produkte (gemäß MDCG 2022-06);
3. Die Produkte stellen kein unvertretbares Risiko für die Gesundheit oder Sicherheit von Patienten, Anwendern oder anderen Personen oder für andere Aspekte des Gesundheitsschutzes dar;
4. Der Hersteller hat spätestens bis zum 26. Mai 2025 ein Qualitätsmanagementsystem gemäß Artikel 10 Absatz 8 der IVDR eingerichtet;
5. Der Hersteller hat spätestens zu folgenden Terminen einen formellen Antrag bei einer Benannten Stelle auf Konformitätsbewertung eingereicht und vier Monate später zur Unterzeichnung gebracht:
I. 26. Mai 2025 für Produkte der Risikoklasse D
II. 26. Mai 2026 für Produkte der Risikoklasse C
III. 26. Mai 2027 für Produkte der Risikoklasse B
IV. vor Ablauf des Zertifikat nach Richtlinie 98/79/EG für betreffende Produkte
Die Produkte, die durch ein Zertifikat gemäß der Richtlinie 98/79/EG abgedeckt sind, unterliegen in der Zeit weiterhin der Überwachung durch die Benannte Stelle.
Unabhängig von diesen Verlängerungen gelten zudem weiterhin bereits für die Bestandsprodukte die Anforderungen der IVDR zur Überwachung nach dem Inverkehrbringen, der Marktüberwachung, der Vigilanz und der Registrierung der Produkte und der Wirtschaftsakteure.
Zur Umsetzung hat die EU Kommission ein Q&A on practical aspects parallel veröffentlicht.
